Intrebarea-cheie: Care este diferența între autorizația de urgență a vaccinului contra Covid-19 și cea completă?
Postat la: 24.08.2021 | Scris de: ZIUA NEWS
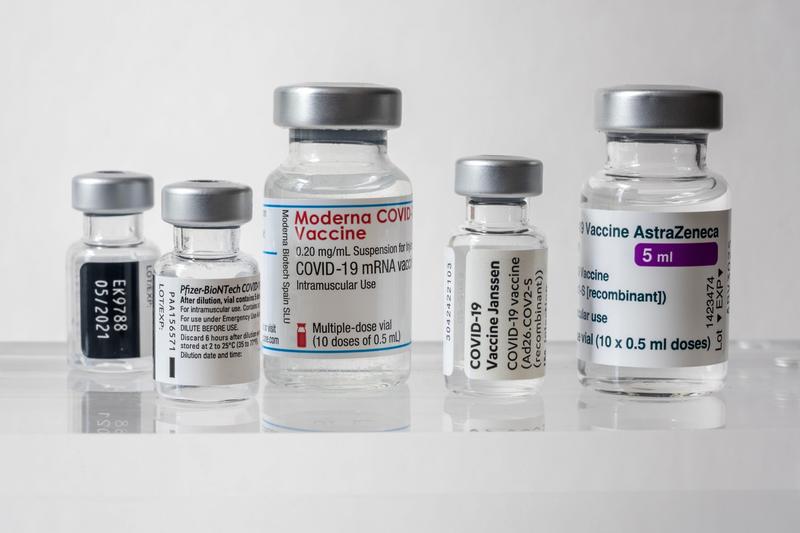
Autorizația pentru utilizarea de urgență (EUA) a primit multă atenție în timpul pandemiei. Conceptul Asociației pentru Alimente și Medicamente a SUA (FDA) de autorizare a unui produs sau a unui tratament în mod rapid, fără o analiză absolut completă a fost introdus în anul 2005, scrie ContagionLive.
La acel moment, FDA a emis o EUA pentru vaccinul contra antraxului, disponibil pentru personalul militar, după apariția unor scrisori cu antrax ce au ucis sau împolnăvit peste 20 de oameni. În următorii ani, au fost emise EUA pentru o varietate de terapii experimentale pentru boli precum H1N1 (gripa porcină), MERS, Ebola și Zika, ce au apărut rapid și amenințau să devină pandemii. Începând de anul trecut, au fost emise mai multe autorizații de urgență pentru produse contra Covid-19, inclusiv teste de diagnosticare și de anticorpi, tratamente clinice și vaccinuri.
Potrivit Dianei Zuckerman, președintele National Center for Health Research din SUA, există mai multe motive pentru care o companie ar putea să nu ceară aprobarea totală a unui produs. "Unul dintre motive poate fi acela că se descoperă că nu funcționează, așa că nu se fac eforturi să fie aprobat, iar altul este că firma nu are neapărat motivația de a face cercetările necesare pentru aprobare din cauză că standardele pentru EUA sunt tot timpul mai reduse decât cele pentru aprobarea FDA", a spus ea.
"Dacă aprobarea FDA necesită un studiu mai mare, pe termen mai lung, cu mai mulți pacienți, s-ar putea să nu merite", a explicat experta, dând ca exemplu EUA date pentru diferite terapii contra virusului Ebola, care nu prezintă la acest moment un pericol pentru Statele Unite. Chiar dacă o companie vrea să primească aprobarea completă pentru un produs, poate întâmpina probleme dacă nu găsește destui pacienți pentru a participa în teste pe scară largă, a adăugat Susan Wood, profesor la Universitatea George Washington și fost angajat FDA.
Zuckerman și Wood spun că, în mod ideal, companiile care produc terapii ce primesc EUA continuă să caute aprobarea completă pentru aceste terapii, mai ales în condițiile în care aceste pot fi folosite și pentru alte boli decât cele gândite inițial. "Motivul pentru care am putut să ne mișcăm rapid cu Covid s-a datorat muncii făcute deja cu alți coronaviruși, asta chiar a fost o pregătire pentru situație. Chiar dacă este pentru o boală rară sau o viitoare pandemie pe care nu o putem prezice, a avea mai multe informații te ajută mai târziu", a afirmat Zuckerman.
Pentru companii, aprobarea completă este o măsură de controlare a situației. FDA poate retrage o EUA oricând, oprind o firmă să-și vândă produsul. În contrast, e nevoie de câțiva ani pentru ca agenția americană pentru medicamente să retragă o aprobare completă. De asemenea, firmele de asigurări, de obicei, nu acoperă produsele sub EUA, deși, în cazul vaccinurilor contra coronavirusului, guvernele plătesc nota de plată. Autorizațiile de urgență sunt menite să ajute oamenii să primească imediat ajutor, nu este un lucru neobișnuit ca teste sau terapii ce au primit EUA să se dovedească ineficiente.
În cazul testelor și tratamentelor pentru Covid-19, FDA a emis EUA pe care ulterior le-a revocat. De exemplu, în martie 2020, companiilor li s-a permis să vândă teste de anticorpi - menite să arate dacă ai avut sau nu Covid în trecut - fără să înainteze cereri pentru acordarea de EUA. În mai 2020, companiile au avut voie să vândă teste de diagnosticare a Covid timp de 15 zile lucrătoare înainte să fie obligate să depună cererile de EUA. În acea lună FDA a emis 84 de EUA pentru diferite laboaratoare și companii, iar alte 400 de cereri așteptau răspuns.
Dar, până în februarie 2021, fuseseră strânse destul date privind testările de FDA, care a respins 225 de teste diferite pentru anticorpi. De asemenea, deși în martie 2020 FDA dăduse autorizația de urgență pentru folosirea hidroxiclorochinei, până în iunie 2020 a devenit clar din studiile clinice că medicamentul nu numai că nu aduce beneficii clare, dar poate fi chiar dăunător pentru pacienții cu Covid, așa că EUA a fost retrasă în iunie 2020.
Lipsa aprobării complete a FDA a fost invocată și ca factor în reticența unor oameni de a primi vaccinul FDA și este și un punct central al disputei privind obligativitatea vaccinului. De obicei, obligativitatea vine după ani de experiență cu un vaccin. "În mod normal, testarea durează, procedurile dintre FDA și comapnii sunt lente, procesul de evaluare este lent și produsul ajunge pe piață în mod gradual", a explicat Wood.
La acel moment, există mai multă acceptare în rândul populației generale. "Acum, totul a fost comprimat, inclusiv EUA, și ajungem direct la obligativitatea (vaccinării pentru angajați) impusă de firme", a mai spus Wood. Vaccinul contra bolii provocate de coronavirus dezvoltat de Pfizer și BioNTech a primit luni autorizare deplină din partea Administrației pentru Medicamente și Alimente din SUA, decizie care ar putea ajuta mai mulți angajatori în dorința de a cere salariaților să se imunizeze împotriva Covid-19.
-

Secretul murdar al Europei: Bătrânul continent se prăbușește în ritm accelerat
În contextul în care Donald Trump este pe punctul de a prelua din nou Casa Albă peste câteva săptămâni, iar economia Eur ...
-

CCR a anulat alegerile degeaba: Nu Rusia, ci PNL a atacat cibernetic România in campania lui Călin Georgescu. Un document ANAF confirmă manipularea de pe TikTok
O ancheta incendiara a snoop.ro demonstreaza ca promovarea masiva a lui Calin Georgescu de pe tik-tok nu a fost un atac ...
-

Asasinarea generalului rus: a fost publicată prima mărturie a suspectului reţinut
Rusia a reţinut un cetăţean uzbek despre care anchetatorii cred că a plasat bomba care l-a ucis pe generalul Igor Kirill ...
-

Ies la iveală abuzuri inimaginabile ale lui Alfred Bulai. Își bătea elevele de școală generală la fundul gol pe care le apleca peste bancă
Fostul profesor de la SNSPA, Alfred Bulai, este tinta unor noi dezvaluiri. Astfel, actualelor victime li se adaugă amint ...
-

Fostul dictator sirian Bashar al-Assad deține proprietăți imobiliare in România conform unei liste publicate de Wall Street Journal
Odată cu căderea regimului fostului președinte sirian Bashar al-Assad, a început o „vânătoare internațională" pentru bun ...
-

Fost procuror general identifică o greșeală care ar putea fi speculată de Călin Georgescu
Fostul procuror general al României, Augustin Lazăr, spune că serviciile secrete și Consiliul Suprem de Apărare al Țării ...
-

Până la urmă, rușii lui Putin, sau oamenii lui Trump l-au propulsat pe orbita prezidentialelor pe Georgescu?
Ceva interesant: în noaptea de duminică spre luni, când numărătoarea voturilor la parlamentare era în toi, apare o posta ...
-

O să iasă un iureș de nedescris: Horațiu Potra a condus operațiuni neoficiale în numele statului român
Horațiu Potra, omul arestat pentru că ar fi urmărit să producă tulburări sociale și deținea mai multe arme în mașină, a ...
-

Cercetarile secrete ale Pentagonului: Reîncarnarea este reală. Pe ce informații se bazează raportul serviciilor de informatii
Un raport al serviciilor de informații ale armatei americane, redactat în 1983 și desecretizat de CIA în 2003, a revenit ...
-

A fost virusul Covid scăpat dintr-un laborator chinez? Cea mai plauzibilă variantă, conform unei comisii din SUA
O comisie a Congresului american privind pandemia de COVID-19 a publicat luni, 2 decembrie, un raport în care consideră ...
-

Presa americană: Viziunea lui "Trump de România" - respingerea războaielor perpetue și a politicilor woke!
Dacă ești atent la context și la preocupările cetățenilor obișnuiți, victoria lui Georgescu în România nu a fost deloc u ...
-

Viața fiicelor țarului. Cine sunt Maria, Katerina și Luiza Rozov: între nunţi de miliarde și cariere departe de lumina reflectoarelor
Putin și-a păzit mereu cu gelozie viața privată, protejând-o în special pe cea a fiicelor sale, Maria și Katerina, născu ...
-

De ce ar fi fost chemat Marcel Ciolacu la Budapesta. Telefonul care a schimbat soarta României!
Ascensiunea fulminantă a lui Călin Georgescu, candidatul independent care a dat toate calculele peste cap după ce s-a ca ...
-

O criză mondială uriașă despre care nimeni nu vorbește: urmează un colaps major pentru jumătate dintre cele mai mari economii ale lumii
Îmbătrânirea populației globale pune deja presiune asupra finanțelor publice, iar agențiile de rating avertizează că dec ...
-

-

Bolojan a dat jos 28 de statui românești și a pus 10 monumente pentru Ungaria!
Ascunse într-o firidă din spatele marii clădiri a actualului Muzeu al Țării Crișurilor, zac roase de mucegai și găinaț d ...
-

Rachetele folosite de Rusia în Ucraina conțin componente occidentale: descoperiri alarmante despre lanțurile globale de aprovizionare
Între ianuarie și noiembrie 2024, Rusia a lansat 194 de rachete balistice asupra Ucrainei, atingând un vârf al atacurilo ...
-

Angela Merkel face dezvăluiri. Fostul cancelar al Germaniei nu crede in șarada lui Donald Trump
Angela Merkel, care, în noile sale memorii, îşi exprimă temerile cu privire la ordinea democratică occidentală cu Donald ...
-
Rusia vrea o nouă ordine mondială și fragmentarea Ucrainei într-un plan secret adresat SUA
Rusia intenționează să prezinte Statelor Unite un plan detaliat pentru conturarea unei noi ordini mondiale până în anul ...
-

Păun Gabriel de la Ocolul Silvic Vidra, caz clasic de infractor-pacient scăpat de la Bălăceanca
Ziarul nostru a relatat pe larg cum Baza experimentală a Ocol Silvic Vidra aparținând de INCDS MARIN DRACEA București, a ...
-

Suveica PSD-AUR: Interpușii PSD l-au propus în funcția de director general al Romprest pe fiul patronului Realitatea Plus care are banii băgați la AUR
Compania Națională Aeroporturi București (CNAB) l-a propus în funcția de președinte al CA și director general al Rompres ...
-

Departamentul de Stat al SUA a finanțat Ateismul pe plan global
Un raport al Camerei Reprezentanților din Statele Unite acuză Departamentul de Stat că a promovat ateismul în lume, sub ...
-

Reportaj Hotnews: Ce înseamnă „expulzările în masă" pe care vrea să le facă Donald Trump. Primele semne că lucrurile se schimbă în America au apărut deja
Corespondentul HotNews în SUA a stat de vorbă cu imigranți și avocați din Philadelphia specializați în acest domeniu pen ...
-

Ciolacu, Grindeanu și Simonis au călătorit de mai multe ori la Nisa cu jet privat închiriat de Nordis împreună cu fetițele favorite
Președintele PSD, Marcel Ciolacu, ministrul transporturilor Sorin Grindeanu (PSD) și Alfred Simonis (pe atunci deputat P ...
-

Lovitură de teatru în scandalul fraudării fondurilor europene la OS Vidra. Clasare a cauzei pentru șase dintre cei anchetați timp de un an
Ziarul nostru a relatat pe larg cum Baza experimentală a Ocol Silvic Vidra aparținând de INCDS MARIN DRACEA București, a ...
-

Mișcarea pe care o face miliardarul Warren Buffett ridică multe semne de întrebare. Se pensionează sau anticipează criza financiară?
Berkshire Hathaway, condusă de legendarul investitor Warren Buffett, a publicat recent rezultatele economice, care arată ...
-

Trump face o promisiune-șoc: "Voi spune adevărul despre OZN-uri și marile secrete ale lumii"
Donald Trump a declarat că, din prima zi a noului său mandat, va începe refacerea imaginii Statelor Unite, după ce a înv ...
-

Ministra Sănătății din Olanda: Operatiunea "Covid" a fost o punere in scenă a NATO
Un membru al guvernului Olandei a recunoscut că pandemia Covid a fost o „operațiune militară", dezvăluind că, în timpul ...
-

HG-ul care dovedește faptul că Vila din Aviatorilor este pregătită pentru Klaus Iohannis cu semnătura lui Nicolae Ciucă
În ședința de Guvern s-a luat decizia desecretizării Hotărârii de Guvern prin intermediul căreia s-a recondiționat, de c ...
-

Proiectul "Burduja" pentru vânzarea țării: Lacurile de acumulare din România vor fi cedate străinilor. Interesul e unul enorm
Conform proiectului de lege care se află în prezent în consultare publică, lacurile de acumulare din România pot și vor ...