Comisia Europeană a suspendat comercializarea a 700 de medicamente
Postat la: 28.07.2015 | Scris de: ZIUA NEWS

Comisia Europeană (CE) a decis luni să suspende comercializarea a 700 de medicamente generice testate de o societate indiană pentru mai multe laboratoare, printre care se numără Sanofi (Franţa), Mylan (SUA), Ranbaxy (India), Teva (Israel), după ce în urma unei inspecţii franceze efectuate anul trecut s-au descoperit nereguli în studiile de bioechivalenţă, relatează AFP.
Executivul comunitar a pus astfel în practică o recomandare a Agenţiei Europene pentru Medicamente (EMA), care a solicitat din luna ianuarie suspendarea comercializării unor medicamente generice testate la Hyberabad de compania indiană GVK Biosciences.
EMA reproşează acestei societăţi că a furnizat informaţii incorecte în studiile de bioechivalenţă necesare obţinerii autorizaţiei de comercializare a medicamentelor. Obiectivul unui studiu de bioechivalenţă este să garanteze că acţiunea terapeutică a medicamentului generic este identică cu aceea a medicamentului de referinţă.
Decizia CE se va aplica de pe 20 august în toate statele Uniunii Europene, însă ar putea fi solicitate excepţii de până la doi ani pentru unele medicamente considerate 'critice' şi care pot fi greu substituite. Dar unele state, precum Franţa, Germania, Belgia şi Luxemburg, au hotărât încă de la sfârşitul anului trecut suspendarea comercializării medicamentelor avute în vedere de actuala decizie a CE.
Agenţia Franceză a Medicamentelor (ANSM), a efectuat anul trecut o inspecţie în urma căreia a constatat 'manipulări ale datelor electrocardiogramelor' şi a decis suspendarea comercializării a 33 de generice, printre care se numără antidepresive, antihistaminice sau substanţe pe bază de ibuprofen pentru care există alternative.
Potrivit directorului adjunct al ANSM, chiar dacă electrocardiogramele nu constituie un element esenţial în demonstrarea bioechivalenţei, societatea GVK Biosciences 'nu a respectat bunele practici' şi există semne de întrebare cu privire la corectitudinea studiilor realizate.
În urma acestei sesizări a ANSM, dar şi a altor laboratoare, EMA a reevaluat fiabilitatea studiilor clinice efectuate de societatea GVK Biosciences şi a cerut apoi Comisiei Europene suspendarea comercializării a 700 dintre cele 1.000 de medicamente generice testate. Acestea vor putea fi comercializate din nou odată ce laboratoarele care au apelat la serviciile respectivei companii indiene vor furniza noi studii de bioechivalenţă.
-

O teorie tulburătoare despre călătoria în timp a fizicienilor de la Universitatea din Tampere
Este posibilă călătoria în timp? O echipă de fizicieni de la Universitatea din Tampere a venit cu o potențială soluție l ...
-
Un misterios avion american de lux, echipat și adaptat de către armata americană, zărit în vestul României
Un avion de lux a fost echipat și adaptat de către armata americană pentru a efectua misiuni de apărare antiaeriană. În ...
-

Cum să îți îmbunătățești aspectul dinților?
Cel mai important accesoriu al tău este un zâmbet frumos. Adesea, este primul lucru pe care oamenii îl observă când te c ...
-

Un amplu studiul indică Dieta Keto pentru prevenirea și tratarea bolii Alzheimer
Atunci când organismul își epuizează zahărul din sânge, după ce a aspirat tot ce a putut din depozitele de glicogen din ...
-

Sateliții Starlink ai lui Elon Musk ar putea eroda câmpul magnetic al Pământului și să ne otrăvească pe toți!
Un fost fizician de la NASA a declarat pentru DailyMail că gunoaiele spațiale ar putea afecta atmosfera Pământului, ducâ ...
-

Posibilele probleme de sănătate post-vaccinare ARNm pentru Ioan Aurel Pop presedintele Academiei Române: "Controlul medical a relevat o anomalie dar cred cu alte cauze"
Ioan Aurel Pop a vorbit deschis despre problemele de sănătate pe care le-a constatat după administrarea serului „COVID". ...
-

Fenomenele El Nino și La Nina fac prăpăd în România și în Europa: vreme extremă nu s-a mai văzut
Variațiile termice și climatice devin din ce în ce mai extreme, iar în mai multe regiuni europene pătrund valuri de căld ...
-

Povestea "călătorului în timp" Javier. Singurul supraviețuitor al Pământului din 2028?!
Un bărbat misterios, numit „Javier", susține că trăiește în viitor, mai exact în 2028. Relatările „călătorului în timp" ...
-

UE nu a ajuns la un acord privind moneda virtuală. De ce este așa de importantă moneda euro digitală și ce se va întâmpla cu plățile cash
"Am început faza pregătitoare a proiectului euro digital. Această fază a început în noiembrie, după o perioadă fructuoas ...
-

Reincepe isteria: OMS are o "îngrijorare enormă" că virusul H5N1 se va adapta și se va transmite de la om la om într-o pandemie colosală
Organizaţia Mondială a Sănătăţii (OMS) şi-a exprimat joi "îngrijorarea enormă" faţă de răspândirea în creştere a tulpini ...
-
O creatură misterioasă cu 170 de ochi, descoperită pe fundul mării
Într-o expediție marină în regiunea Huidong din sudul Chinei, cercetătorii au făcut o descoperire uimitoare în 2023. Ei ...
-

Nebunie în Orientul Mijlociu: zeci de avioane și-au schimbat brusc traseul, după ce Israelul a declanșat atacul
Mai multe avioane care survolează Iranul și-au schimbat brusc traseul. Decizia a fost luată imediat după exploziile din ...
-
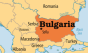
Răsturnare de situație: Aderarea Bulgariei la zona euro se amână
Dacă Bulgaria nu reuşeşte să îndeplinească ţintele de inflaţie ale Băncii Centrale Europene (BCE) în iunie, aderarea sa ...
-

Episcopul înjunghiat la Sydney și-a revenit: "Îl iert pe atacator. Îl iubesc și mă voi ruga pentru el"
Episcopul care a fost înjunghiat în mijlocul unei predici care era transmisă în direct pe internet spune că se simte "bi ...
-

O legislație propusă în SUA deschide calea identificării obligatorii online sub pretextul verificării vârstei
În Camera Reprezentanților din SUA sunt în desfășurare eforturi legislative bipartizane în sensul adoptării unor versiun ...
-

Comisia Europeană alocă 1,4 miliarde de euro pentru pandemii viitoare și pentru 100 de orașe neutre din punct de vedere climatic. Ce orașe din România au fost selectate
Comisia Europeană (CE) a suplimentat cu aproape 1,4 miliarde de euro bugetul alocat Programului Orizont Europa, finanțar ...
-

NASA: China folosește programe civile pentru a ascunde obiective militare în spațiu
Şeful agenţiei spaţiale americane NASA, Bill Nelson, a declarat miercuri în Congres că China foloseşte programe civile p ...
-

Vice-guvernatorul băncii centrale din Israel spune că rolul numerarului s-a „erodat" și e depășit tehnologic. El a anunțat testarea șekelului digital
Andrew Abir, guvernatorul adjunct al Băncii Israelului, a spus recent că numerarul tradițional a fost cândva competitiv ...
-

Baba Vanga și Nostradamus profețesc Al Treilea Război Mondial: ce oras va arde din temelii la inceputul conflagratiei
Baba Vanga este renumită pentru serie sa de previziuni, unele dintre ele extrem de tulburătoare. Multe dintre acestea au ...
-

Israelul pregătește o mare operațiune terestra: armata a fost pregătită și a primit arme cu mare putere de foc
Israelul ar fi desfăşurat artilerie suplimentară şi transportoare blindate de trupe la periferia Fâşiei Gaza, ceea ce su ...
-

Angajații Google cer anularea unui contract uriaș al companiei cu guvernul israelian. Protestatarii, scoși cu forța din birouri de polițiști
Zeci de angajați Google au participat la proteste în birourile companiei din New York și California. Gigantul IT are un ...
-

Carnea artificială din plante este mai rea pentru sănătate decât consumul de carne adevărată STUDIU
Participanții la studiu care au consumat diete pe bază de plante nu au văzut beneficii pentru sănătate, scrie Daily Mail ...
-

Scandal prvind libertatea individuală: Marea Britanie a aprobat cea mai dură lege antifumat luată vreodată în lume
Parlamentarii din Marea Britanie au aprobat marţi cu o majoritate covârşitoare legea care interzice tuturor celor născuţ ...
-

O româncă bolnava de cancer se luptă cu Elon Musk in instante. Fosta angajata a companiei Tesla: "Vreau să-mi reabilitez numele înainte de a muri!"
Cristina Bălan, o româncă, denunțător de integritate al Tesla, care s-a luptat cu Elon Musk și compania sa prin tribunal ...
-

Profesor emerit la Universitatea din Osaka: "Pandemia a fost folosită ca pretext fals de către OMS pentru a stimula vaccinarea tuturor popoarelor" VIDEO
Profesorul emerit al Universitatii de Medicină din Osaka, Masayasu Inoue, are o reactie inedita intr-un moment crucial p ...
-
Americanii au o certitudine medicală: Sindromul long-Covid ar fi cauzat de vaccinul ARN mesager
Cercetătorii americani de la InCellDx au descoperit că simptomele long-Covid sunt identice cu simptomele post-vaccin și ...
-
România poate pierde teritorii. Ungaria forțează autonomia ținutului secuiesc după ce am pierdut recursul impotriva Comisiei Europene
România a pierdut recursul la Curtea de Justiție Europeană într-un proces crucial pentru țara noastră. Este vorba despre ...
-

Un cunoscut predicator internațional a fost înjunghiat în direct în fața altarului. Atacul a fost urmărit online de mii de oameni
Orașul Sydney a fost zguduit de un atac asupra unui cunoscut preot crestin care a fost atacat de un bărbat înarmat într- ...
-

Trăiască Războiul! Compania Lockheed Martin a câștigat un contract de apărare antirachetă din Statele Unite în valoare de 17 miliarde de dolari
Compania Lockheed Martin a primit un contract în valoare de 17 miliarde de dolari pentru dezvoltarea următoarei generați ...
-

Cea mai puternică explozie din istorie de la Big Bang, văzută de omenire: Dezvăluie un nou mister
Un obiect necunoscut la acea vreme, aflat la o distanță colosală de Pământ a produs cea mai puternică explozie de radiaț ...